Las propiedades de los aminoácidos derivan de su estructura química.
Recordemos que son moléculas que cuentan con un grupo ácido (carboxilo) –COOH y un grupo amina –HN2. Estos grupos están unidos a un carbono denominado carbono a. Este carbono se une también a un átomo de hidrógeno (H) y a una cadena lateral variable que identifica y da propiedades características a cada uno de los aminoácidos.
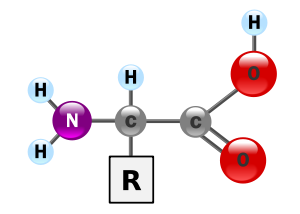
Entre las propiedades de los aminoácidos se pueden destacar las siguientes:
Carácter anfótero. Una molécula se denomina anfótera cuando puede comportarse 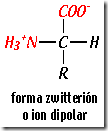 como un ácido o como una base dependiendo del pH del medio donde se encuentre. Éste es el caso de los aminoácidos: al tener un grupo carboxilo pueden desprender protones (H+) por lo que tienen carácter ácido; por otra parte, al poseer un grupo amino, son capaces de aceptar protones (H+) y, por tanto, también tienen carácter básico.
como un ácido o como una base dependiendo del pH del medio donde se encuentre. Éste es el caso de los aminoácidos: al tener un grupo carboxilo pueden desprender protones (H+) por lo que tienen carácter ácido; por otra parte, al poseer un grupo amino, son capaces de aceptar protones (H+) y, por tanto, también tienen carácter básico.
 como un ácido o como una base dependiendo del pH del medio donde se encuentre. Éste es el caso de los aminoácidos: al tener un grupo carboxilo pueden desprender protones (H+) por lo que tienen carácter ácido; por otra parte, al poseer un grupo amino, son capaces de aceptar protones (H+) y, por tanto, también tienen carácter básico.
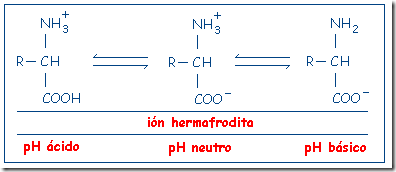
como un ácido o como una base dependiendo del pH del medio donde se encuentre. Éste es el caso de los aminoácidos: al tener un grupo carboxilo pueden desprender protones (H+) por lo que tienen carácter ácido; por otra parte, al poseer un grupo amino, son capaces de aceptar protones (H+) y, por tanto, también tienen carácter básico.Al pH existente habitualmente en los medios biológicos, cercano a la neutralidad (pH=7) ambos grupos suelen estar ionizados y los amino ácidos aparecen como iones dobles (esto se suele llamar ión zwitterión, que procede del griego “hermafrodita”).
A un pH más ácido, los aminoácidos tendrán carga neta positiva, pues los H+ del medio son captados por el grupo carboxilo ionizado, neutralizando éste y quedando únicamente la carga del grupo amino.
Por el contrario, en un pH más básico, el grupo amino cederá un H+ al medio y el aminoácido quedará con carga negativa.
La cadena lateral (R) puede tener grupos ionizables que participan en la carga eléctrica del aminoácido.
El valor de pH para el cual un aminoácido tiene carga neta 0, es decir, posee tantas cargas positivas como negativas, se denomina punto isoeléctrico. Como cada aminoácido pre senta un punto isoeléctrico di ferente, ya que posee cadenas laterales distintas, se puede uti lizar un método de separación de aminoácidos, denominado electroforesis, que se basa en este concepto. Dicho método consiste en situar una disolu ción de los aminoácidos que se quieren separar en un campo eléctrico. Los aminoácidos con carga neta negativa se despla zarán hacia el ánodo, mientras que los que tengan carga posi tiva lo harán hacia el cátodo y los que se encuentren en su punto isoeléctrico no se mo verán. Al modificar el pH de la disolución, las cargas de los aminoácidos irán variando y se podrán separar en el campo eléctrico.
Estereoisomería. Como el carbono a es asimétrico existen dos estéreo-isómeros con distinta actividad óptica. Para diferenciar ambos isómeros en una fórmula plana, se escribe la cadena lateral R hacia arriba y los grupos amino y carboxilo a ambos lados del carbono a: el grupo amino se sitúa a la derecha para representar el estereoisómero D y a la izquierda para representar el estereoisómero L.
Todos los aminoácidos proteinogénicos son isómeros L, aunque es posible encontrar D-aminoácidos en determinados compuestos biológicos, en la pared bacteriana o en ciertos antibióticos.
Existen ciertos procesos metabólicos que permiten sintetizar aminoácidos, lo que quiere decir que se pueden obtener a partir de otras moléculas. Sin embargo, esto no siempre es posible, ya que algunos aminoácidos no se pueden sintetizar y es nece sario obtenerlos a través de los alimentos. Estos aminoácidos se denominan amino ácidos esenciales y son diferentes para cada especie. En el ser humano se consideran esenciales ocho aminoácidos,, aunque el número según algunos autores podría ascender hasta 10.
La pérdida de la capacidad de síntesis podría ser una respuesta adaptativa ante la fácil disponibilidad de un determinado aminoácido en la dieta, por lo que no sería necesaria su síntesis endógena.
No hay comentarios:
Publicar un comentario