La estructura tridimensional de una proteina es un factor determinante en su actividad biológica. Tiene un carácter jerarquizado, es decir, implica unos niveles de complejidad creciente que dan lugar a 4 tipos de estructuras: primaria, secundaria, terciaria y cuaternaria.
Cada uno de estos niveles se construye a partir del anterior.
La ESTRUCTURA PRIMARIA esta representada por la sucesión lineal de aminoácidos que forman la cadena peptídica y por lo tanto indica qué aminoácidos componen la cadena y el orden en que se encuentran. El ordenamiento de los aminoácidos en cada cadena peptídica, no es arbitrario sino que obedece a un plan predeterminado en el ADN.
Esta estructura define la especificidad de cada proteina.
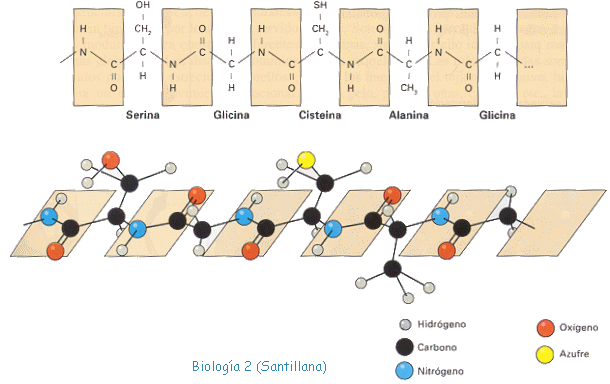
La ESTRUCTURA SECUNDARIA está representada por la disposición espacial que adopta la cadena peptídica (estructura primaria) a medida que se sintetiza en los ribosomas. Es debida a los giros y plegamientos que sufre como consecuencia de la capacidad de rotación del carbono  y de la formación de enlaces débiles (puentes de hidrógeno).
y de la formación de enlaces débiles (puentes de hidrógeno).
Las formas que pueden adoptar son:
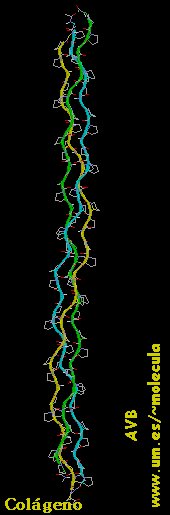
a) Disposición espacial estable determina formas en espiral (configuración 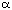 -helicoidal y las hélices de colágeno)
-helicoidal y las hélices de colágeno)
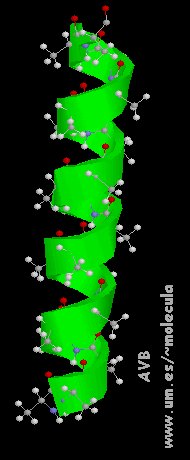
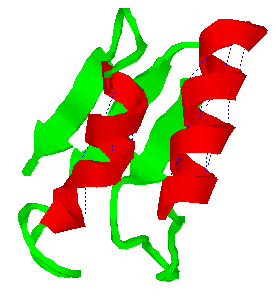
Las  -hélice aparecen en rojo.
-hélice aparecen en rojo.
b) Formas plegadas (configuración  o de hoja plegada).
o de hoja plegada).
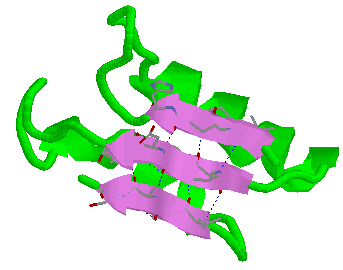
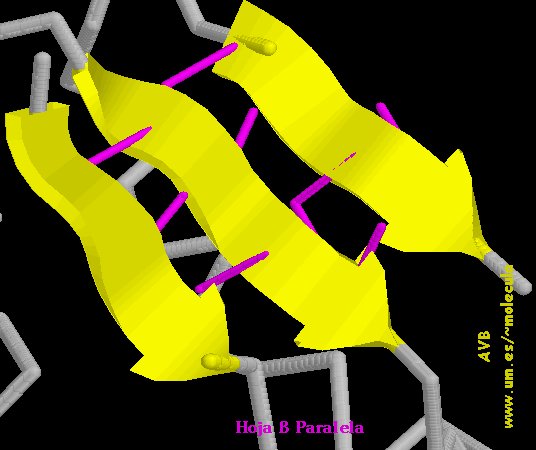
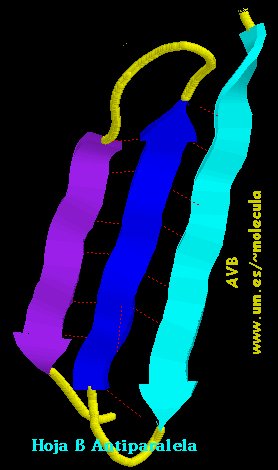
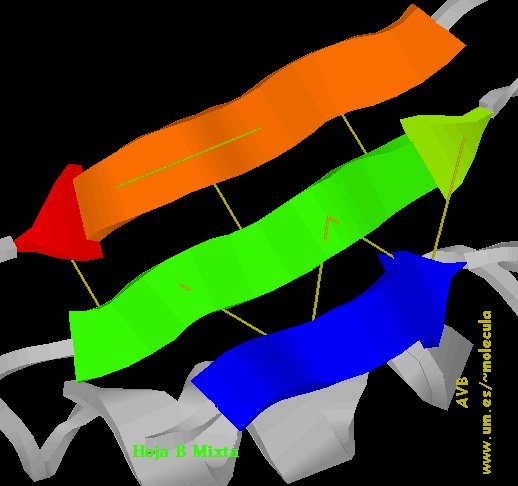
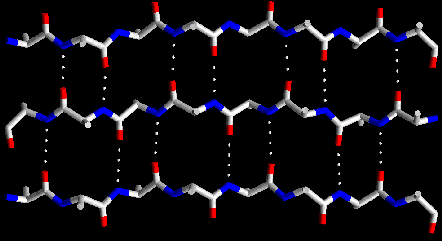
c) También existen secuencias en el polipéptido que no alcanzan una estructura secundaria bien definida y se dice que forman enroscamientos aleatorios. Por ejemplo, ver en las figuras anteriores los lazos que unen entre sí 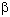 -hojas plegadas.
-hojas plegadas.
La ESTRUCTURA TERCIARIA esta representada por los superplegamientos y enrrollamientos de la estructura secundaria, constituyendo formas tridimensionales geométricas muy complicadas que se mantienen por enlaces fuertes (puentes disulfuro entre dos cisteinas) y otros débiles (puentes de hidrógeno; fuerzas de Van der Waals; interacciones iónicas e interacciones hidrofóbicas).
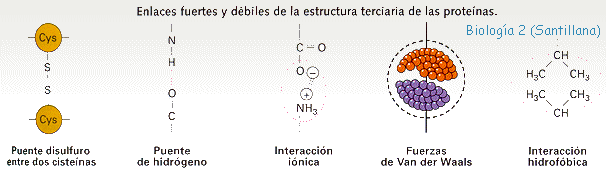
Desde el punto de vista funcional, esta estructura es la más importante pues, al alcanzarla es cuando la mayoría de las proteinas adquieren su actividad biológica o función.
Muchas proteínas tienen estructura terciaria globular caracterizadas por ser solubles en disoluciones acuosas, como la mioglobina o muchos enzimas.
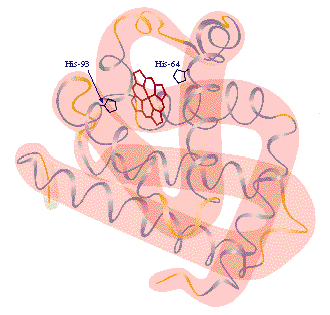
Sin embargo, no todas las proteinas llegan a formar estructuras terciarias. En estos casos mantienen su estructura secundaria alargada dando lugar a las llamadas proteinas filamentosas, que son insolubles en agua y disoluciones salinas siendo por ello idóneas para realizar funciones esqueléticas. Entre ellas, las más conocidas son el colágeno de los huesos y del tejido conjuntivo; la  -queratina del pelo, plumas, uñas, cuernos, etc...; la fibroina del hilo de seda y de las telarañas y la elastina del tejido conjuntivo, que forma una red deformable por la tensión.
-queratina del pelo, plumas, uñas, cuernos, etc...; la fibroina del hilo de seda y de las telarañas y la elastina del tejido conjuntivo, que forma una red deformable por la tensión.
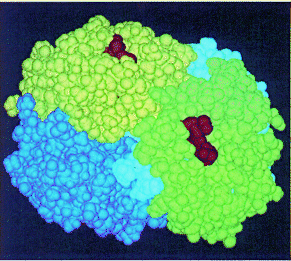
La ESTRUCTURA CUATERNARIA está representada por el acoplamiento de varias cadenas polipeptídicas, iguales o diferentes, con estructuras terciarias (protómeros) que quedan autoensambladas por enlaces débiles, no covalentes. Esta estructura no la poseen, tampoco, todas las proteinas. Algunas que sí la presentan son: la hemoglobina y los enzimas alostéricos.
No hay comentarios:
Publicar un comentario