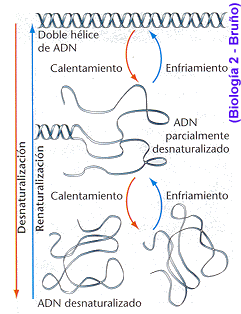
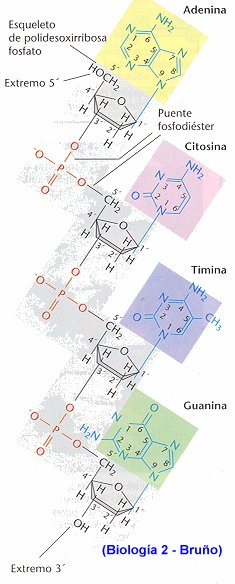
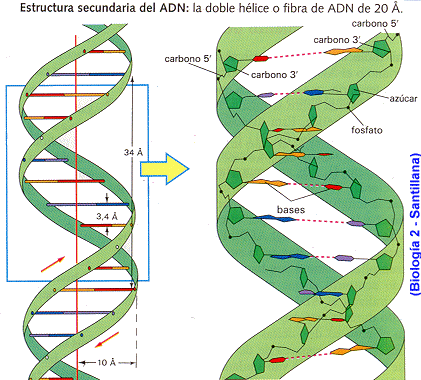
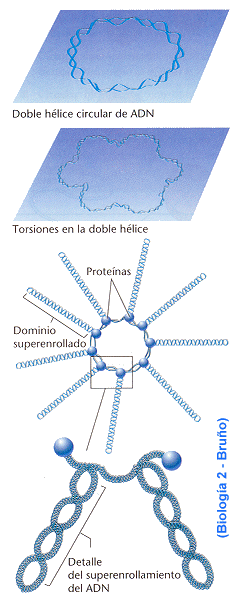
Se habla de centrifugación cuando tenemos partículas de distinto tamaño en un medio acuoso, éstas sedimentan hacia el fondo a una velocidad que depende de su peso. Este efecto podría utilizarse para separar componentes de distinto peso si no fuera porque las velocidades de sedimentación son pequeñísimas, por lo que el sistema no es útil.
Así, pues lo que se hace es aumentar dichas velocidades de sedimentación haciendo girar muy rápidamente la mezcla. En este caso, la fuerza centrípeta hace el papel de la gravedad (peso) y puede ser mucho mayor que éste haciendo girar muy rápido la mezcla: este es el principio de la centrifugación y de la ultracentrifugación. Se coloca la mezcla en un aparato que la haga girar a velocidad angular constante muy elevada. Una vez está girando, la mezcla experimenta una aceleración centrípeta que puede llegar a ser, en ultracentrifugadoras de laboratorio, unas 500000 veces la aceleración de la gravedad. Esta fuerza empuja a sedimentar, a distinta velocidad, a las partículas de distinta masa de la mezcla, creándose distintos estratos con las partículas de cada clase. Este método es muy utilizado en biología y medicina.
CENTRIFUGACIÓN DE GRADIENTE
La centrifugación en gradiente de densidad es el método preferido para la purificación de orgánulos subcelulares y macromoléculas. Se generan gradientes de densidad creando capas de medios de gradientes (Tabla 2) como la sacarosa en un tubo, la capa más pesada en la base y la más liviana en la parte superior en modo discontinuo o continuo. La fracción de células a separar se coloca encima de la capa y se la centrifuga. La separación en gradiente de densidad se clasifica en dos categorías: 2a. Separación zonal (en base al tamaño). 2b. Separación isopícnica (en base a la densidad).
CENTRIFUGACIÓN DIFERENCIAL
En primer lugar, se logra producir la separación en base al tamaño de las partículas en la centrifuagación diferencial. Este tipo de separación suele utilizarse en peletizaciones sencillas y en la preparación parcialmente pura de orgánulos subcelulares y macromoléculas. Para estudiar orgánulos subcelulares, se rompen los tejidos o las células para que liberen su contenido. La mezcla cruda de células destruidas se conoce con el nombre de homogenato. Durante la centrifugación de un homogenato de células, las partículas más grandes se sedimentan más rápido que las pequeñas, lo que permite obtener fracciones de orgánulos crudos por medio de la centrifugación diferencial. Un homogenato de células puede ser sometido a centrifugación en series de fuerzas-g progresivamente más intensas y así generar pellets de orgánulos parcialmente puros.
Cuando un homogenato de células recibe una centrifugación de 1000 x g durante 10 minutos, las células sin romper y los núcleos pesados se peletizan en el fondo del tubo. El supernadante puede centrifugarse nuevamente a 10.000 x g durante 20 minutos a fin de peletizar orgánulos subcelulares de velocidades intermedias tales como la mitocondria, los lisosomas y los microorganismos. Algunos de estos orgánulos sedimentados se pueden obtener parcialmente puros y suelen estar contaminados con otras partículas. El lavado repetitivo de los pellets por medio de la resuspensión en solventes isotónicos y la repeletización puede lograr el desprendimiento de contaminantes pequeños (Figura 1) La obtención de orgánulos parcialmente purificados por medio de centrifugación diferencial representa el primer paso para una mayor purificación en la que se utilizan otros tipos de separación centrífuga (separación en gradiente de densidad).

ULTRACENTRIFUGACIÓN
La ultracentrifugación analítica consiste en un importante conjunto de poderosos métodos (velocidad y equilibrio de sedimentación) para la determinación del tamaño, la forma global aproximada, y el grado de homogeneidad de proteínas y otras macromoléculas biológicas en disolución. Estos métodos están especialmente adaptados para la detección y la caracterización cuantitativa (estequiometría, afinidad, reversibilidad) de las interacciones que dan lugar a la formación de complejos macromoleculares, que incluyen interacciones proteína-proteína, DNA- proteína y receptor- ligando.